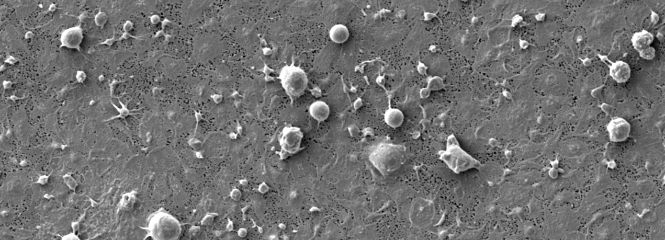
Schwerpunkt unserer Forschung ist die Entwicklung von Verfahren zur extrakorporalen Blutreinigung, insbesondere Adsorptionstechnologien in verschiedenen Anwendungen und die unterstützende Therapie von Inflammation und Sepsis.
In diesem Kontext beschäftigen wir uns mit der Blutverträglichkeit von Biomaterialien, mit dem Einfluss von Antikoagulationsverfahren auf die Blutverträglichkeit extrakorporaler Verfahren, mit der Weiterentwicklung von blutverträglichen Oberflächen, mit Zellkulturmodellen zur Untersuchung der Aktivierung des Endothels unter septischen Bedingungen, sowie mit der Rolle und biologischen Aktivität von extrazellulären Vesikeln.
Ausgezeichnete Infrastruktur und ein laufend weiterentwickeltes Methodenspektrum auf dem Gebiet der medizinischen Verfahrenstechnik, der Zellkultur und der medizinischen Biochemie sowie Kooperationen mit klinischen Partnern ermöglichen den Transfer von Forschungsergebnissen aus der Grundlage in die Anwendung.
Infrastruktur
Das Zentrum für Biomedizinische Technologie verfügt über eine Laborfläche von ca. 500 m² mit Ausstattung im Bereich Biochemie, Medizinische Verfahrenstechnik, Mikrobiologie sowie Zellbiologie. Die Labors sind für Arbeiten der biologischen Sicherheitsstufen 1 und 2 ausgestattet. Weiters steht eine Core Facility mit erweiterter Ausstattung im Bereich Bio-Imaging zur Verfügung.
- Autoanalyzer für klinische Laborparameter (Cobas/Roche C311)
- Chromatographische Trennverfahren (Säulenchromatographie, HPLC)
- Durchflusszytometer (Cytoflex LX) und Cell Sorter (FACSymphony S6)
- Elektronenmikroskop mit EDX-Funktion (Hitachi FLEXSEM-1000) und Sputter-Coater
- Fluoreszenz-Mikroskopie (Olympus BX51)
- Gel-Elektrophorese und Gel-Dokumentationssystem (BioRad ChemiDocTM XRS)
- Gerinnungsanalysator und Thrombingenerationstest (Sysmex CA-560)
- Luminex Bead Array
- Messgerät zur Blutbildbestimmung (Sysmex XN 330)
- PCR (Roche Light Cycler 96) und MagNA Pure
- Zellkulturmodelle (ibidi µ-slide microfluidic system)
- Konfokales Mikroskop (Leica)
- Nanoparticle Tracking Analyzer NTA (ZetaView TWIN)
Über etablierte Kooperationen besteht Zugang zu
- Atomic Force Microscopy
- Cell Sorter
- Cryo-Elektronenmikroskopie (Tecnai F30 Polara transmission electron microscope)
- Imaging Flow Cytometry (ImageStreamx MkII cytometer, Amnis)
Methodenspektrum
- Ausschlussgrößenbestimmung mittels HPLC
- Bestimmung von Zytokinen und Mediatoren: ELISA, Luminex Bead Array
- Blutbild, Gerinnungsanalytik, Thrombingeneration
- Charakterisierung von Adsorbern für die extrakorporale Blutreinigung:
- Adsorptionskapazität
- Adsorptionskinetik
- Porenstruktur
- Oberfläche
- Ausschlussgrenzen
- Charakterisierung von extrazellulären Vesikeln:
- Durchflusszytometrie
- Imaging Flow Cytometry
- Interaktion mit Blutzellen
- Gerinnungsaktivierung
- Immunmodulation
- Nanoparticle Tracking Analysis
- Charakterisierung von Membranen:
- Siebkoeffizient
- Transmembrandruck
- Filtrationsraten
- Einfluss von Antikoagulationsverfahren auf die Blutverträglichkeit
- Elektrophorese & WesternBlotting
- Endotoxinbestimmung mittels Limulus-Amöbozyten-Lysat Test
- Untersuchung der Aktivierung von Blutzellen an Polymeroberflächen
- Zellkulturmodelle zur Untersuchung der Aktivierung von Endothelzellen unter septischen Bedingungen
Tags